Video Overlay Titlle
Video Overlay description
La información presentada en este sitio está dirigida únicamente a profesionales de la salud, si usted selecciona "ACEPTO" está verificando que es un profesional de la salud en México.
No
¿Porque utilizar los anticuerpos anti-CLDN18 para detectar CLDN18.2 en muestras de tumores G/UGE?
Los anticuerpos anti-CLDN18 pueden identificar ambas isoformas de CLDN18: CLDN18.1 y CLDN18.2. Sin embargo, cuando analice muestras de tejido de tumores G/UGE, puede confiar en atribuir la tinción a la presencia de CLDN18.2 debido a que2,3:
Preparación y estudio previo de las muestras
Manejar y preparar adecuadamente la muestra es esencial para garantizar la exactitud de los resultados de biomarcadores1 .
Dr. Takeshi Kuwata

Las guías recomiendan el mantenimiento diario del procesador de tejidos conforme a las recomendaciones del fabricante y un mantenimiento riguroso de la calidad de los líquidos del procesador, incluido el pH/pureza del formol y la contaminación del agua con alcoholes1.
El tiempo de isquemia fría se limitará a ≤60 minutos de acuerdo con las guías actuales1.
Las guías proporcionan recomendaciones sobre las características y la duración de la fijación de la muestra1.
El tejido deberá estar completamente sumergido en el fijador.
Asegúrese de que la relación entre el volumen del fijador y la masa de tejido no sea inferior a 4:1, siendo la relación óptima de 10:1.
La parafina se derretirá a <60 °C.
La muestra contendrá suficiente tejido tumoral para su análisis.
Como parte de su estabilización, el tejido se fijará en formol al 10 % en tampón fosfato neutro (pH 7,0) durante al menos 6 horas y no más allá de 24 a 36 horas.
Si el tejido tiene un alto contenido en grasa, la fijación podrá requerir hasta 48 horas.
Es importante optimizar las variables pre-analíticas para minimizar los artefactos de tinción, que pueden interferir en la puntuación.
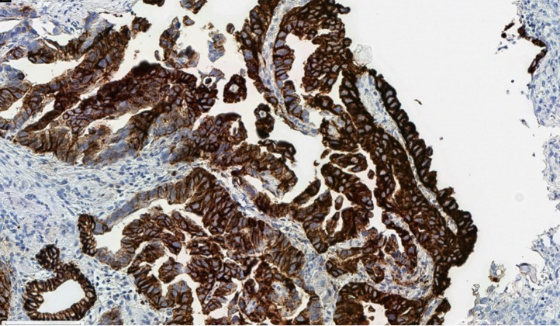
Decoloración citoplasmática debido a una fijación deficiente, lo que puede interferir con una puntuación adecuada de la membrana.
Los tejidos procesados de forma rutinaria, fijados con formol e incluidos en parafina (FFPE), son adecuados para su uso en pruebas de IHQ.
Las muestras obtenidas mediante punción con aguja fina (PAF), las muestras de citología o de lesiones óseas metastásicas no son adecuadas para la tinción de CLDN18.
Los cortes de tejido puede ser de 3-6 µm*
Antes de la tinción, las laminillas con los cortes deberán secarse por completo a temperatura ambiente (secado al aire)
o en el horno a 60 °C durante 60 minutos*.
Para garantizar la integridad de las muestras, las zonas de conservación deberán estar:
Secas
Libres de plagas
A temperatura ambiente (18-25 °C)

Hay varios anticuerpos, pruebas y plataformas disponibles para la evaluación de la expresión de CLDN18.2. Entre las pruebas y anticuerpos se encuentran la prueba de DIV VENTANA CLDN18 (43-14A), el anticuerpo anti-CLDN18 LSBio PathPlus™ y el anticuerpo recombinante anti-claudina 18 (43-14A). Entre las opciones de plataformas se encuentran BenchMark ULTRA, Dako Autostainer y Leica Bond4.
Esta lista de anticuerpos/pruebas y plataformas no es exhaustiva, y las pruebas mencionadas anteriormente no constituyen en la actualidad diagnósticos complementarios autorizados por la FDA. Utilice la prueba adecuada para orientar la toma de decisiones clínicas.
Prueba de DIV VENTANA CLDN18
(43-14A) IVD AssayMás información
LSBio PathPlusTM
Anticuerpo anti-CLDN18Más información
Anticuerpo recombinante anti-claudina 18 de Abcam (43-14A)Más información
Dr. Christoph Röcken,MD
Es esencial utilizar controles adecuados para la detección de CLDN18.2 en muestras de tumores G/UGE. Aquí tienen algunos puntos clave para su selección y uso5.
Las guías recomiendan que los laboratorios validen o verifiquen las pruebas de inmunohistoquímica antes de ponerlas al servicio clínico. Además, deberán incluir tejido positivo, negativo y dudoso, que reflejen el uso previsto de la prueba5
En el mercado hay varios tejidos de control de distintos proveedores:
CAP PPMPT: College of American Pathologists Preanalytics for Precision Medicine Project Team (Equipo del proyecto de preanálisis para medicina de precisión del Colegio de Patólogos Estadounidenses); CLDN: claudina; CLDN18.1: isoforma 1 de la claudina 18; CLDN18.2: isoforma 2 de la claudina 18; DIV: diagnóstico in vitro; FDA: Administración de Alimentos y Medicamentos de Estados Unidos; IHQ: inmunohistoquímica; G/UGE: gástrico/unión gastroesofágica.
En un estudio de evaluación de la reproducibilidad y comparabilidad de tres anticuerpos anti-CLDN18 y plataformas de tinción con IHQ en una cohorte de 27 laboratorios generales4,*,†:
*Los anticuerpos del estudio comprendían la prueba DIV VENTANA CLDN18 (43-14A) de Roche Tissue Diagnostics, el anticuerpo anti-CLDN18 PathPlus™ de LSBio y el anticuerpo anti-claudina-18 de Novus Biologicals. Entre las plataformas se encuentran BenchMark ULTRA, Dako Autostainer y Leica Bond4.
†Las puntuaciones consenso de referencia de todos los anticuerpos para cada muestra se determinaron mediante revisión patológica a nivel central. La positividad para CLDN18.2 se definió con un umbral ≥75 % de células tumorales que expresaban CLDN18 de membrana con una intensidad de tinción de moderada a intensa (≥2+). En consecuencia, se pidió a los patólogos participantes que enviaran una opción binaria de tinción positiva/negativa así como una estimación del porcentaje de células teñidas. El puntaje de IHQ enviadas por el laboratorio se compararon con el puntaje del consenso de referencia y se consideraron discordantes si el resultado binario positivo/negativo difería. Los análisis estadísticos se realizaron mediante comparación y se aplicó un criterio de aceptación del 85 % (≥0,85)4.

Las guías recomiendan testear en el momento del diagnóstico todos los biomarcadores aplicables disponibles, como HER2, en caso de identificación o sospecha de cáncer gástrico metastásico6.
Las guías de la ESMO recomiendan realizar una prueba para la CLDN18.26.
Cualquier nuevo biomarcador se probará simultáneamente con otros biomarcadores para permitir una notificación temprana de los resultados6,7.
En una cohorte de pacientes con tumores avanzados de diferentes tipos de cáncer (N = 1423), el establecimiento de un protocolo de pruebas realizadas en el momento del diagnóstico se asoció a una mejora de la supervivencia global7.
Tenemos evidencias de que la implementación inmediata de las pruebas, mejora los resultados de los pacientes. Es fundamental que, en el momento del diagnóstico, los patólogos defiendan la realización de los biomarcadores aplicables prevalentes
Dr. Matteo Fassan, MD, PhD


Referencias: 1. Compton CC, Robb JA, Anderson MW, et al. Preanalytics and precision pathology: pathology practices to ensure molecular integrity of cancer patient biospecimens for precision medicine. Arch Pathol Lab Med 2019;143(11):1346-63. 2. Ventana CLDN18 (43-14A) assay [package insert]. Mannheim, Germany: Roche Diagnostics GmbH. 3. Sahin U, Koslowski M, Dhaene K, et al. Claudin-18 splice variant 2 is a pan-cancer target suitable for therapeutic antibody development. Clin Cancer Res 2008;14(23):7624-34. 4. Jasani B, Schildhaus HU, Taniere P, et al. Global ring study determining reproducibility and comparability of CLDN18 testing assays in gastric cancer. Poster presented at: ESMO Targeted Anticancer Therapies Congress; March 6-8, 2023; Paris, France. 5. College of American Pathologists. IHC assays—New evidence-based guideline for analytic validation (04-01-2004). https://documents.cap.org/documents/ihc-validation-webinar-handout.pdf. Accessed 03-30-2023. 6. ESMO Gastric Cancer Living Guidelines (07-2023). https://www.esmo.org/living-guidelines/esmo-gastric-cancer-living-guideline/diagnosis-pathology-and-molecular-biology/article/diagnosis-pathology-and-molecular-biology. Accessed 09-07-2023. 7. Piening B, Bapat B, Weerasinghe RK, et al. Improved outcomes from reflex comprehensive genomic profiling-guided precision therapeutic selection across a major US healthcare system [Abstract 6622]. J Clin Oncol 2023;41(Suppl 16).